단백질의 구조를 아미노산 전자 분포의 관점으로 이해하기
단백질의 구조 Structures of proteins
생명체가 기능하기 위해서 필수적인 물질이 있습니다. 그 중 하나는 단백질입니다. 오늘의 주제는 단백질의 구조입니다.
1. 단백질이란?
단백질이란 대체 뭘까요?
저는 일단 단백질을 아미노산 중합체라고 얘기하고 싶습니다. 아미노산 중합체를 이해하기 위해선 우선 중합체가 뭔지 알아야 합니다.
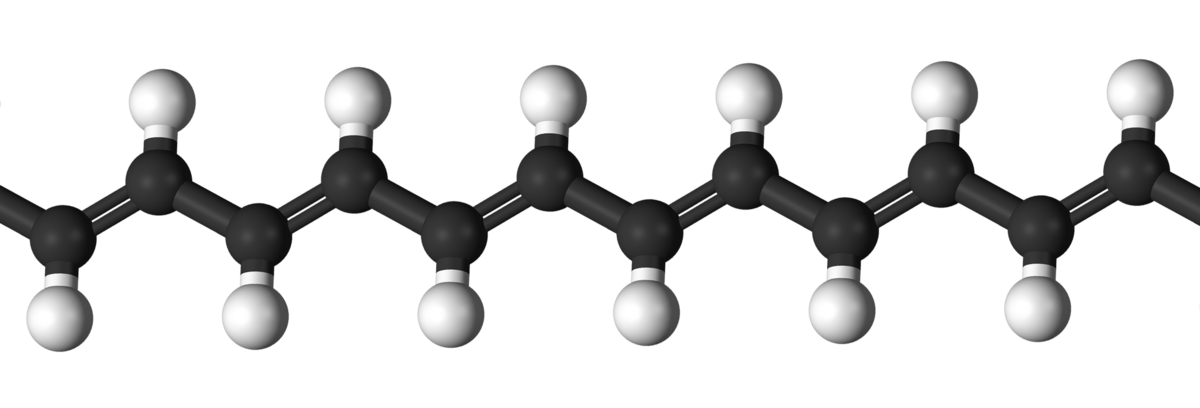
중합체는 단위체가 반복되어 연결된 고분자입니다. 이 그림 상에서 탄소와 수소가 연결된 단위체가 반복되어 연결되어있지요. 이런걸 중합체라고 합니다.
아미노산이 반복되어 연결된 고분자를 아미노산 중합체라고 합니다. 그럼 아미노산을 알아야 단백질을 이해할 수 있을 겁니다.
1-1 아미노산 고분자
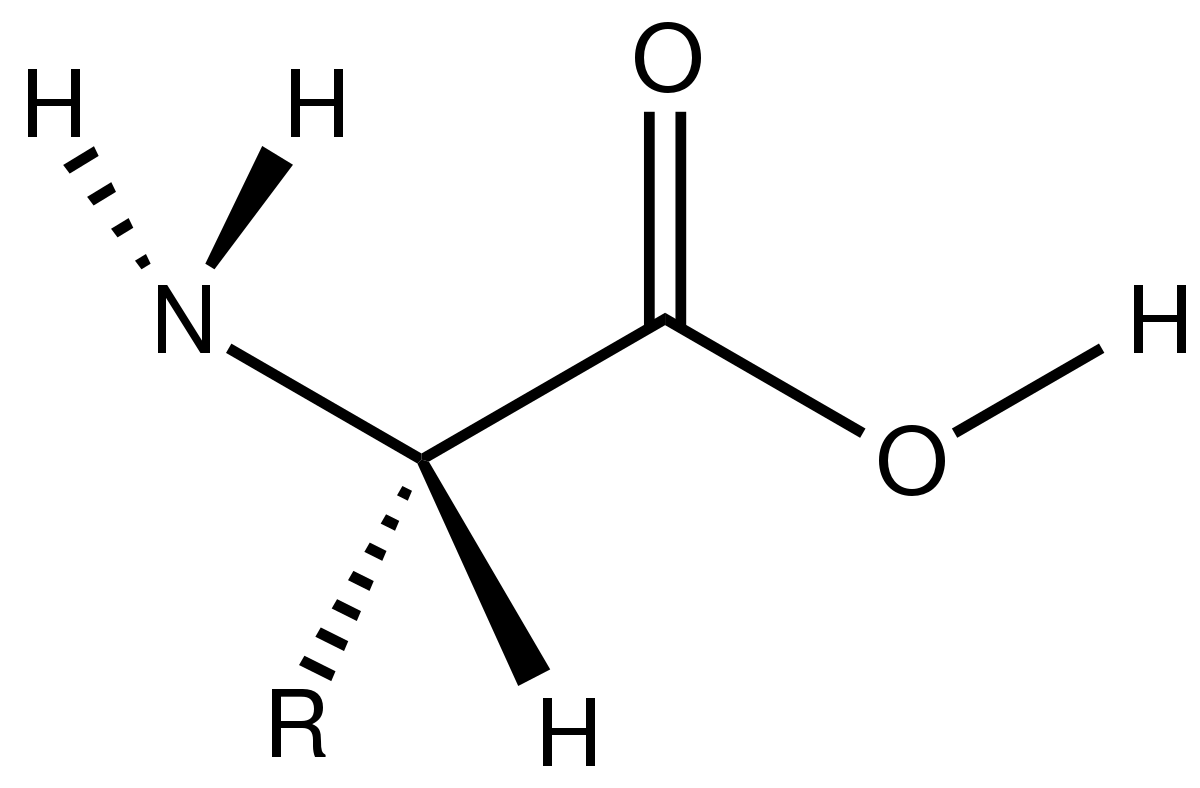
아미노산은 이렇게 생긴 분자입니다.중앙에 중심탄소를 두고 아미노기(-NH2), 카복실기(-COOH), 곁사슬(R)이 중심 탄소에 연결된 구조이지요.
곁사슬은 20가지 종류가 있습니다. 곁사슬이 무엇인지에 따라 어떤 아미노산인지가 결정되지요. 각각의 곁사슬은 전자 분포가 다르게 생겼고, 이게 매우 중요합니다.
전하가 있는 극성 아미노산은 곁사슬에 전자가 하나 많거나 부족합니다. 이런 아미노산은 전자를 하나 주거나, 하나 빼앗는 반응을 할 수 있죠. 전하가 없지만 극성인 아미노산은 곁사슬에 NH2, 혹은 OH기가 풍부하기 때문에 부분적으로 전하를 띠고 있습니다. 물과 수소결합이 잘 일어납니다. 비극성 아미노산은 탄화수소로 주로 구성되기 때문에 비극성입니다. 물 분자와 끌어당기는 힘이 부족하죠. 그리고 어느 분류에도 해당하지 않는 기타 아미노산까지 총 20가지 아미노산의 곁사슬이 있고, 단백질은 이 20가지 아미노산이 조합되어 연결된 고분자입니다.
그 중합체를 간단히 표현하자면 이렇게 되겠지요. R1, R2, R3, R4는 각각의 아미노산의 곁사슬입니다. 곁사슬에 따라 어떤 아미노산인지가 결정되겠지요. 이런 구조를 peptide chain이라고 부릅니다.
1-2 Peptide Chain
Peptide chain은 20가지 아미노산의 다양한 조합과 배열로 다양한 구조를 나타낼 수 있습니다.
만약 이렇게 인접한 아미노산들끼리 전자 밀도가 높고 낮은 부분이 교차한다면 어떻게 될까요? 전하가 반대인 부분끼리는 공간적으로 더 가까워져야 에너지가 낮은 상태에 있습니다. 모든 물질은 에너지가 낮은 방향으로 자발적으로 이동하지요.
그 결과 이런 식으로 사슬이 변형될 겁니다. 이런 방식으로 서로 가까워진 아미노산 중합체를 알파나선이라고 합니다.
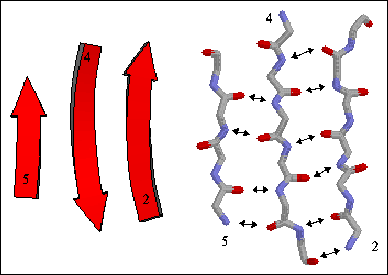
반면, 연속된 아미노산의 전하가 교차되어 연결된 peptide chain이 있다고 해봅시다. 에너지가 낮은 상태로 가기 위해서 이 peptide chain은 접히는게 유리하겠지요. 이런 방식으로 생기는 단백질의 구조를 베타 판이라고 부릅니다.
단백질은 peptide chain이 아미노산 전자 분포에 따라 꼬이거나 접힌 구조입니다.
2. 단백질 구조에 영향을 미치는 다른 분자들
그럼 아미노산 배열의 전자 분포에 따라 가장 에너지가 낮은 형태로 단백질의 구조가 결정된다고 생각할 수도 있습니다. 그건 틀렸습니다. 왜냐면 단백질은 다른 분자들과도 상호작용하기 때문입니다.
2-1 물
단백질은 거의 항상 물 속에 있죠. 극성 아미노산은 물과 수소결합을 할 수 있기 때문에 전기적으로 물과 친하고, 비극성 아미노산은 전기적으로 물과 친하지 않습니다. 따라서 어떤 아미노산 배열은 물 속에서 극성 부분은 물과 접하는 바깥쪽 방향을 향하고, 비극성 부분은 물과 접하지 않는 안쪽 방향으로 꼬입니다.
2-2 세포막 지질
어떤 단백질들은 지용성 부분이 인지질인 세포막 속에 들어가고 수용성 부분이 물 속에 녹아있습니다. 이렇게 세포막에 박혀서 세포 안과 밖의 물질과 상호작용하는 단백질을 막단백질이라고 합니다.
2-3 다른 Peptide Chain들
여러 peptide chain들 끼리 상호작용하면서 단백질을 구성하기도 합니다. 산소를 운반하는 헤모글로빈은 4개의 peptide chain이 결합한 구조입니다. 생체 구조물끼리 결합시켜주는 단백질인 콜라젠은 알파나선 3가닥이 꼬여 만들어진 삼중나선 구조입니다. 밧줄 같은 구조의 콜라젠은 그 기능도 밧줄과 같습니다.
이렇듯, 단백질의 기능은 그 구조에 의해 결정됩니다.
3. 단백질의 구조는 기능을 결정한다
헤모글로빈은 적혈구 속에 있는 단백질입니다. 헤모글로빈은 산소와 결합해서 산소를 운반합니다. 실제로 헤모글로빈의 사슬은 헴을 붙잡고 있는 구조이고, 헴 내부의 2가 철 이온은 산소와 결합합니다.
헴을 붙잡을 수 있는 구조가 되기 위해서 유리한 전자분포를 헤모글로빈 단백질은 띠고 있지요.
이런 사슬 4개가 모여서 헤모글로빈을 이룹니다. 적혈구 내부에 존재하면서 산소를 빠르고 효율적으로 운반하기 위해서 원자 9000개가 넘는 구조가 필요한 것이지요.
요약하자면
단백질의 구조와 기능은 전자 분포가 결정합니다.
단백질은 전자 분포에 따라 다양한 분자들과 상호작용하며 그 구조가 만들어지고,
다른 분자들과 상호작용하는 기능이 생깁니다.